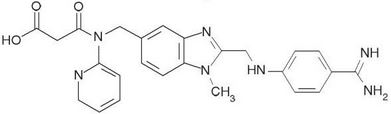
Dabigatran
| Le informazioni qui riportate non sono consigli medici e potrebbero non essere accurate. Questa voce ha solo scopo illustrativo e non sostituisce il parere di un medico: leggi le avvertenze. |
| Clicca su "►" per espandere: |
Indice
SPECIALITÀ
- Pradaxa
- 10 CPS 75MG, 30 CPS 75MG monografia, Riassunto EMA
- 10 CPS 110MG, 30 CPS 110MG , 60 CPS 110MG monografia, Riassunto EMA
- 60 CPS 150MG monografia, Riassunto EMA
STRUTTURA
MECCANISMO D’AZIONE
Dabigatran è un anticoagulante appartenente alla categoria degli inibitori diretti della trombina ed è il primo in questa categoria somministrabile per via orale.
Poiché la trombina (proteasi della serina) consente la conversione del fibrinogeno in fibrina nella cascata della coagulazione, la sua inibizione previene la formazione di trombi. Dabigatran inibisce la trombina libera, la trombina legata a fibrina e l’aggregazione delle piastrine indotta dalla trombina.
L’effetto di questo farmaco nel prevenire la formazione di coaguli di sangue in pazienti che sono stati sottoposti a un intervento di sostituzione dell’anca o del ginocchio è paragonabile a quello dell'enoxaparina, ed essendo assunto per via orale, Dabigatran ha il vantaggio di essere più comodo per i pazienti.
Inoltre, Dagibatran, paragonato alla Warfarin, risulta altrettanto efficace nel ridurre il rischio di ictus in pazienti con fibrillazione atriale, senza aumentare il rischio di importanti emorragie.
INDICAZIONI
- Pradaxa 75 mg, 110mg: Prevenzione della formazione di coaguli del sangue nelle vene a seguito di interventi di chirurgia per sostituzione del ginocchio o dell’anca negli adulti.
- Pradaxa 110mg, 150mg: Prevenzione di ictus e coaguli di sangue nei pazienti con battito cardiaco anomalo denominato fibrillazione atriale non valvolare, che sono considerati a rischio di ictus. i fattori di rischio sono i seguenti:
- Precedente ictus, attacco ischemico transitorio o embolia sistemica (ES)
- Frazione di eiezione del ventricolo sinistro < 40 %
- Insufficienza cardiaca sintomatica, ≥ Classe 2 della classificazione della New York Heart Association (NYHA)
- Età ≥ 75 anni
- Età ≥ 65 anni associata con una delle seguenti condizioni: diabete mellito, coronaropatia o ipertensione.
CONTROINDICAZIONI
- Ipersensibilità al principio attivo
- Pazienti con grave e insufficienza renale (CLCr < 30 ml/min)
- Pazienti con un’emorragia significativa in atto o con un’affezione che li espone al rischio di gravi emorragie.
- Pazienti che assumono un qualsiasi altro medicinale anticoagulante, fatta eccezione per specifiche situazioni, per esempio se il paziente sta abbandonando un trattamento per iniziare la cura con Dabigatran o viceversa. Esempi di medicinali anticoagulanti: eparina non frazionata (ENF), eparine a basso peso molecolare (enoxaparina, dalteparina ecc.), derivati dell'eparina (fondaparinux ecc.), anticoagulanti orali (warfarin, rivaroxaban, apixaban ecc.)
- Pazienti con gravi problemi epatici
- Pazienti che assumono, per via orale o endovenosa, i medicinali antimicotici ketoconazolo e itraconazolo, i farmaci immunosoppressori ciclosporina e tacrolimus o dronedarone (Farmaco usato nel trattamento della fibrillazione atriale)
- Pazienti ai quali è stata impiantata una Protesi valvolare cardiaca.
POSOLOGIA
Le capsule vanno deglutite intere con acqua.
- Pazienti sottoposti a un intervento di sostituzione dell’anca o del ginocchio: il trattamento deve essere iniziato con una capsula da 110 mg, entro 1-4 ore dalla fine dell’operazione. La terapia continua poi con 220 mg (due capsule da 110 mg), una volta al giorno, per 28-35 giorni in caso di sostituzione dell’anca e per 10 giorni in caso di sostituzione del ginocchio. Nei pazienti in cui la sede dell’operazione non ha cessato di sanguinare, l’inizio del trattamento deve essere rinviato. Qualora il trattamento non sia iniziato il giorno dell’intervento, iniziare il trattamento direttamente con 220 mg (due capsule da 110 mg) una volta al giorno.
Ai pazienti con moderata compromissione della funzione renale, con più di 75 anni d'età o in caso di trattamento concomitante con amiodarone, chinidina o verapamil va somministrata una dose inferiore.
- Prevenzione di ictus e coaguli di sangue in pazienti con fibrillazione atriale non valvolare: il dosaggio è di 300 mg (una capsula da 150 mg due volte al giorno) nell’ambito di una terapia di lungo termine. Ai pazienti di età superiore agli 80 anni e nei pazienti trattati anche con verapamil deve essere somministrata una dose inferiore. Si può inoltre decidere di somministrare una dose inferiore in pazienti di età compresa tra i 75 e gli 80 anni, in pazienti con moderata compromissione della funzione renale, in pazienti affetti da gastrite, esofagite o reflusso gastroesofageo e in altri pazienti che presentano un rischio più elevato di emorragia.
I pazienti considerati a rischio più elevato di emorragia devono essere monitorati attentamente e la dose di Dabigatran va diminuita a discrezione del medico.
Valutazione della funzione renale: Prima di iniziare il trattamento, in tutti i pazienti deve essere valutata la funzione renale, per poter escludere i soggetti con grave compromissione della stessa; una seconda valutazione va effettuata durante il trattamento qualora si sospetti un peggioramento. Se questo farmaco viene usato a lungo termine in pazienti con fibrillazione atriale non valvolare, la funzione renale va monitorata almeno una volta all’anno in presenza di compromissione da lieve a moderata o nei soggetti di età superiore ai 75 anni.
AVVERTENZE
- Dabigatran non deve essere prescritto a pazienti con insufficienza renale grave ( clearance della creatinina inferiore a 30 ml/min ). Siccome questo farmaco viene eliminato principalmente per via renale una compromissione delle funzionalita' renali potrebbe portare a livelli eccessivi di farmaco in circolazione, con conseguente rischio di eccessivo sanguinamento.
INTERAZIONI
EFFETTI COLLATERALI
L’effetto indesiderato più comune (osservato in più di 1 paziente su 10) è il sanguinamento