Differenze tra le versioni di "Stronzio ranelato"
(→MECCANISMO D’AZIONE) |
m (Sostituzione testo - '|titlemode= append' con '|titlemode=') |
||
| (14 versioni intermedie di uno stesso utente non sono mostrate) | |||
| Riga 1: | Riga 1: | ||
| + | {{Avvertenze}}{{#seo: | ||
| + | |title= | ||
| + | |titlemode= | ||
| + | |keywords= | ||
| + | |description= | ||
| + | }} | ||
{{categorytreeall|Osteoporosi|mode=all|onlyroot= |depth=}} | {{categorytreeall|Osteoporosi|mode=all|onlyroot= |depth=}} | ||
== SPECIALITÀ == | == SPECIALITÀ == | ||
| − | *'''[[Osseor]]''' 28 bustine 2gr [http://www.ema.europa.eu/docs/it_IT/document_library/EPAR_-_Summary_for_the_public/human/000561/WC500051097.pdf''Riassunto EMA''] , [http://www.dottnet.it/TFI/Allegati.aspx?file= | + | *'''[[Osseor]]''' 28 bustine 2gr [http://www.ema.europa.eu/docs/it_IT/document_library/EPAR_-_Summary_for_the_public/human/000561/WC500051097.pdf''Riassunto EMA''] , [http://www.dottnet.it/TFI/Allegati.aspx?file=2013-08-002514-Osseor.pdf''monografia''] |
| − | *'''[[Protelos]]''' 28 bustine 2gr [http://www.dottnet.it/TFI/Allegati.aspx?file= | + | *'''[[Protelos]]''' 28 bustine 2gr [http://www.dottnet.it/TFI/Allegati.aspx?file=2013-06-002580-Protelos.pdf''monografia''] |
== STRUTTURA == | == STRUTTURA == | ||
| Riga 18: | Riga 24: | ||
== INDICAZIONI == | == INDICAZIONI == | ||
| − | + | Il '''ranelato di stronzio''' è stato autorizzato nell'Unione europea nel 2004 per il trattamento dell’osteoporosi nelle donne in postmenopausa per ridurre il rischio di fratture vertebrali | |
| + | e dell'anca. | ||
| + | Nel 2012, la sua autorizzazione è stata estesa per includere il trattamento dell'osteoporosi negli uomini ad aumentato rischio di fratture. | ||
| + | |||
| + | '''Nel marzo 2012''', a seguito di preoccupazioni sui rischi di tromboembolismo venoso (TEV cioè di formazione di coaguli di sangue nelle vene) e gravi reazioni allergiche cutanee. l'EMA ha raccomandato che il farmaco non deve essere usato in pazienti con TEV o con una storia di tromboembolismo venoso, così come nei pazienti che sono temporaneamente o definitivamente immobilizzati. | ||
| + | |||
| + | '''Nell'aprile 2013''' la EMA ha raccomandato un'ulterior restrizione nell'uso di ranelato di stronzio, a seguito di una valutazione dei dati che mostrano un aumento rischio d'infarto cardiaco rispetto al placebo: '''Il ranelato di stronzio dovrebbe essere utilizzato solo per il trattamento dell’osteoporosi GRAVE (severa) in donne in postmenopausa ad alto rischio di fratture e di osteoporosi GRAVE (severa) negli uomini ad aumentato rischio di fratture''' | ||
| + | |||
==CONTROINDICAZIONI == | ==CONTROINDICAZIONI == | ||
| + | *Ipersensibilità al principio attivo | ||
| + | *Tromboembolismo venoso (TEV) in corso o pregresso, inclusa trombosi venosa profonda ed embolia polmonare. | ||
| + | *Pazienti con storia attuale o passata di cardiopatia ischemica (come l’angina o un attacco cardiaco), arteriopatia periferica o malattia cerebrovascolare | ||
| + | *Pazienti con ipertensione non adeguatamente controllati dal trattamento. | ||
| + | *Immobilizzazione temporanea o permanente dovuta ad esempio ad un intervento chirurgico o ad una prolungata permanenza a letto. | ||
== POSOLOGIA == | == POSOLOGIA == | ||
| − | 2 gr al giorno, da assumere lontano dal cibo, la sera al momento di coricarsi, almeno due ore dopo la cena (latte e | + | 2 gr al giorno, da assumere lontano dal cibo, la sera al momento di coricarsi, almeno due ore dopo la cena (latte e calcio interferiscono con l'assorbimento). |
| − | + | ||
| + | Il Stronzio ranelato non viene metabolizzato dal fegato, non richiede variazioni di dosaggio in caso di insufficienza renale lieve o moderata. | ||
| + | |||
==AVVERTENZE== | ==AVVERTENZE== | ||
| + | *Il rischio di sviluppare malattie cardiovascolari deve essere valutato prima e ad intervalli regolari durante il trattamento (un aumento significativo d'infarto miocardico è stato osservato nei pazienti trattati con il stronzio ranelato rispetto al placebo (1,7% contro 1,1%)) | ||
| + | *Il trattamento con il ranelato di stronzio è stato associato ad un incremento dell'incidenza annuale di tromboembolia venosa (TEV), inclusa l'embolia polmonare. | ||
| + | *Sono state riportate reazioni cutanee a rischio di vita (Sindrome di Stevens-Johnson (SJS), necrolisi epidermica tossica (NET) e rash farmacologico con eosinofilia e sintomi sistemici (DRESS)).<br/>I pazienti devono essere informati dei segni e dei sintomi e attentamente monitorati per le reazioni cutanee. Il rischio maggiore di incidenza per SJS o NET è entro le prime settimane di trattamento e entro 3-6 settimane per DRESS. <br/>Se si presentano i segni e i sintomi di SJS o NET (ad esempio, rash cutaneo progressivo spesso con vesciche e lesioni della mucosa) o DRESS (ad esempio rash, febbre, eosinofilia e coinvolgimento 4 sistemico (ad es. adenopatia, epatite, nefropatia e pneumopatia interstiziale), il trattamento con Stronzio ranelato deve essere interrotto immediatamente. | ||
==INTERAZIONI== | ==INTERAZIONI== | ||
| + | *Il cibo, il latte ed i suoi derivati, e le specialità medicinali contenenti calcio possono ridurre la biodisponibilità del ranelato di stronzio approssimativamente del 60 – 70% | ||
== EFFETTI COLLATERALI == | == EFFETTI COLLATERALI == | ||
| − | + | Gli effetti indesiderati più comuni rilevati (1-10% dei pazienti) sono mal di testa, svenimenti, perdita di memoria, nausea, diarrea, dermatite, eczema (eruzione cutanea con desquamazione), tromboembolia venosa | |
| + | (coaguli ematici nelle vene) e aumento dei livelli di creatin-chinasi nel sangue. | ||
| + | |||
| + | Le reazioni avverse gravi sono discussi nella sezione '''Avvertenze''' | ||
| + | |||
==LINK CORRELATI== | ==LINK CORRELATI== | ||
*[[Osteoporosi]] | *[[Osteoporosi]] | ||
[[Categoria:Principi attivi]] | [[Categoria:Principi attivi]] | ||
[[Categoria:Osteoporosi]] | [[Categoria:Osteoporosi]] | ||
Versione attuale delle 20:33, 26 ago 2014
| Le informazioni qui riportate non sono consigli medici e potrebbero non essere accurate. Questa voce ha solo scopo illustrativo e non sostituisce il parere di un medico: leggi le avvertenze. |
| Clicca su "►" per espandere: |
Indice
SPECIALITÀ[modifica]
- Osseor 28 bustine 2gr Riassunto EMA , monografia
- Protelos 28 bustine 2gr monografia
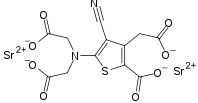
STRUTTURA[modifica]
MECCANISMO D’AZIONE[modifica]
L'osteoporosi è definita come una densità minerale ossea della colonna vertebrale o dell'anca (BMD), che è inferiore di 2.5 o più deviazioni standard rispetto al valore medio di un giovane adulto (T score < -2.5 DS).
Il ranelato di stronzio possiede una duplice azione:
- Aumenta la differenziazione e l'attività degli osteoblasti (osteoblasti sono cellule responsabili della formazione ossea)
- Diminuisce il riassorbimento osseo riducendo la differenziazione degli osteoclasti e la loro attività di riassorbimento. (osteoclasti sono cellule deputate al riassorbimento dell'osso)
Questo determina un riequilibrio del turnover osseo a favore della sua formazione.
INDICAZIONI[modifica]
Il ranelato di stronzio è stato autorizzato nell'Unione europea nel 2004 per il trattamento dell’osteoporosi nelle donne in postmenopausa per ridurre il rischio di fratture vertebrali e dell'anca. Nel 2012, la sua autorizzazione è stata estesa per includere il trattamento dell'osteoporosi negli uomini ad aumentato rischio di fratture.
Nel marzo 2012, a seguito di preoccupazioni sui rischi di tromboembolismo venoso (TEV cioè di formazione di coaguli di sangue nelle vene) e gravi reazioni allergiche cutanee. l'EMA ha raccomandato che il farmaco non deve essere usato in pazienti con TEV o con una storia di tromboembolismo venoso, così come nei pazienti che sono temporaneamente o definitivamente immobilizzati.
Nell'aprile 2013 la EMA ha raccomandato un'ulterior restrizione nell'uso di ranelato di stronzio, a seguito di una valutazione dei dati che mostrano un aumento rischio d'infarto cardiaco rispetto al placebo: Il ranelato di stronzio dovrebbe essere utilizzato solo per il trattamento dell’osteoporosi GRAVE (severa) in donne in postmenopausa ad alto rischio di fratture e di osteoporosi GRAVE (severa) negli uomini ad aumentato rischio di fratture
CONTROINDICAZIONI[modifica]
- Ipersensibilità al principio attivo
- Tromboembolismo venoso (TEV) in corso o pregresso, inclusa trombosi venosa profonda ed embolia polmonare.
- Pazienti con storia attuale o passata di cardiopatia ischemica (come l’angina o un attacco cardiaco), arteriopatia periferica o malattia cerebrovascolare
- Pazienti con ipertensione non adeguatamente controllati dal trattamento.
- Immobilizzazione temporanea o permanente dovuta ad esempio ad un intervento chirurgico o ad una prolungata permanenza a letto.
POSOLOGIA[modifica]
2 gr al giorno, da assumere lontano dal cibo, la sera al momento di coricarsi, almeno due ore dopo la cena (latte e calcio interferiscono con l'assorbimento).
Il Stronzio ranelato non viene metabolizzato dal fegato, non richiede variazioni di dosaggio in caso di insufficienza renale lieve o moderata.
AVVERTENZE[modifica]
- Il rischio di sviluppare malattie cardiovascolari deve essere valutato prima e ad intervalli regolari durante il trattamento (un aumento significativo d'infarto miocardico è stato osservato nei pazienti trattati con il stronzio ranelato rispetto al placebo (1,7% contro 1,1%))
- Il trattamento con il ranelato di stronzio è stato associato ad un incremento dell'incidenza annuale di tromboembolia venosa (TEV), inclusa l'embolia polmonare.
- Sono state riportate reazioni cutanee a rischio di vita (Sindrome di Stevens-Johnson (SJS), necrolisi epidermica tossica (NET) e rash farmacologico con eosinofilia e sintomi sistemici (DRESS)).
I pazienti devono essere informati dei segni e dei sintomi e attentamente monitorati per le reazioni cutanee. Il rischio maggiore di incidenza per SJS o NET è entro le prime settimane di trattamento e entro 3-6 settimane per DRESS.
Se si presentano i segni e i sintomi di SJS o NET (ad esempio, rash cutaneo progressivo spesso con vesciche e lesioni della mucosa) o DRESS (ad esempio rash, febbre, eosinofilia e coinvolgimento 4 sistemico (ad es. adenopatia, epatite, nefropatia e pneumopatia interstiziale), il trattamento con Stronzio ranelato deve essere interrotto immediatamente.
INTERAZIONI[modifica]
- Il cibo, il latte ed i suoi derivati, e le specialità medicinali contenenti calcio possono ridurre la biodisponibilità del ranelato di stronzio approssimativamente del 60 – 70%
EFFETTI COLLATERALI[modifica]
Gli effetti indesiderati più comuni rilevati (1-10% dei pazienti) sono mal di testa, svenimenti, perdita di memoria, nausea, diarrea, dermatite, eczema (eruzione cutanea con desquamazione), tromboembolia venosa (coaguli ematici nelle vene) e aumento dei livelli di creatin-chinasi nel sangue.
Le reazioni avverse gravi sono discussi nella sezione Avvertenze